01
2D细胞培养的局限性

传统2D培养
· 细胞生长环境与行为方面 ·
无法模拟体内三维环境:细胞生长在平坦硬表面,失去体内3D环境,行为与体内差异大,形态常呈扁平状 ,不能再现真实组织三维微环境,影响细胞行为、分化及相互作用。比如成纤维细胞在2D培养中呈扁平状,和组织中双极形状差异大。 细胞与细胞外基质(ECM)相互作用不足:细胞外基质对细胞活动(迁移、增殖、分化等)和结构支持很关键,但2D培养中细胞与细胞外基质以及细胞间相互作用少 ,细胞行为改变,组织特异性活动难以正确建模。
· 细胞生理特性方面 ·
基因表达和功能改变:许多细胞在2D培养环境中随时间推移会失去天然特性,基因表达和功能发生变化 ,对外部因素反应减弱 ,影响生成数据有效性。
无法模拟体内梯度环境:体内组织存在营养物质、氧气和废物的梯度,对维持细胞稳态重要,但2D培养无法模拟,创造出非生理性、均质环境,影响细胞行为和代谢。
· 产业化方面 ·
细胞产量有限:2D培养通常在培养皿、培养瓶等平面容器中进行,细胞只能在二维平面上生长,占用空间大,细胞扩增效率低,难以满足大规模产业化对细胞数量的需求。
综合成本较高:大规模生产时,需要较多的人工操作,同时,由于细胞产量低,单位细胞的生产成本较高。
产品质量不均一:2D培养中,不同区域的细胞受营养物质、气体交换等因素影响存在差异,导致细胞生长状态不一致,产品质量难以保证均一性,给质量控制带来挑战。
放大培养困难:从实验室规模的2D培养扩大到产业化规模时,会面临诸多问题,如培养条件难以精确控制、污染风险增加等,导致工艺放大困难,阻碍了产业化进程。
02
3D细胞培养的优势
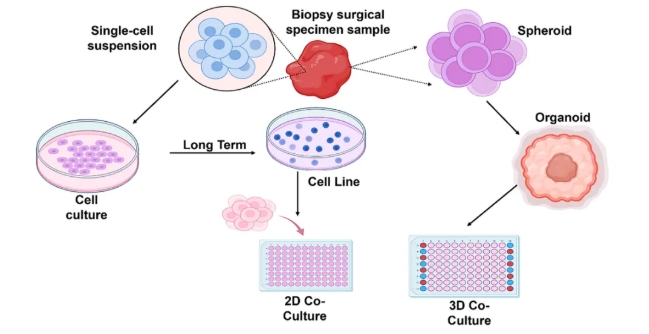
图1:生物医学研究中二维和三维细胞培养的示意图
左图是单层细胞生长的二维培养,右图是细胞组织成球状体和类器官的三维培养
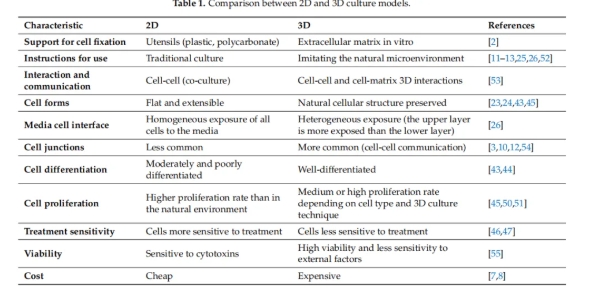
图2:2D和3D培养模型的比较
· 细胞生长环境与行为方面 ·
模拟体内微环境:以细胞外基质(ECM)为依托,模仿自然微环境,再现细胞在体内的三维空间结构和ECM环境,更符合生理状态。
增强细胞与细胞及细胞与外基质相互作用:支持细胞与细胞、细胞与基质间的三维相互作用与通讯,促进细胞间信号传递,对细胞增殖、分化、迁移等过程至关重要。
维持细胞自然形态:能保留细胞天然结构,细胞形态更接近体内状态;2D培养中细胞呈扁平、可伸展形态,与体内差异大。
· 细胞生理特性方面 ·
促进细胞连接形成:细胞连接更为常见,有利于细胞间通讯;2D培养中细胞连接较少。
提升细胞分化程度:细胞分化良好,能更好模拟体内细胞功能;2D培养细胞分化程度一般较差。
合理调控细胞增殖:细胞增殖速率适中或较高(因细胞类型和培养技术而异),更贴近体内实际;2D培养细胞增殖速率常高于自然环境,不能准确反映体内情况。
提高细胞耐受性:对处理(如药物等)敏感性较低,细胞活力高,对外部因素(如细胞毒素)敏感性低,能更稳定维持细胞活性和功能;2D培养细胞对处理更敏感,对细胞毒素等耐受性差。
· 产业化方面 ·
提高生产产量与生产效率:3D培养系统能够实现大规模细胞培养,通过高效利用空间与精准调控培养条件,实现高密度细胞培养,满足大规模生产需求。
降低成本:相较于传统的2D培养,3D培养通过优化培养条件和提高细胞培养效率,减少了人力成本,从长远来看可降低生产成本。
产品质量更稳定:3D培养提供了更均一的培养环境,使细胞的生长、分化和代谢更一致,能更好地维持MSC的生物学特性和功能,从而保证产品质量的稳定性和一致性,有利于产业化生产的标准化和质量控制。
易于放大培养:技术特性上,具有良好的通用性与可扩展性,易于实现从实验室到产业化的放大培养,同时也契合法规对细胞产品的严格要求,为产业化发展提供有力保障。
03
MSCs的3D培养显示了治疗潜力
· 促进多系分化能力 ·
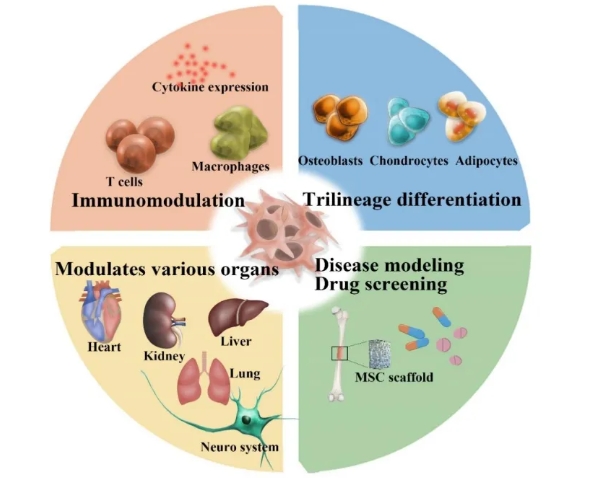
图3:间充质干细胞谱系分化
如图3所示,MSCs具有分化为多种谱系的能力,特别是成骨、软骨和脂肪谱系,以及免疫调节和再生潜力。在3D结构中培养MSCs,可以更真实地研究干细胞的分化、增殖和生物学功能。
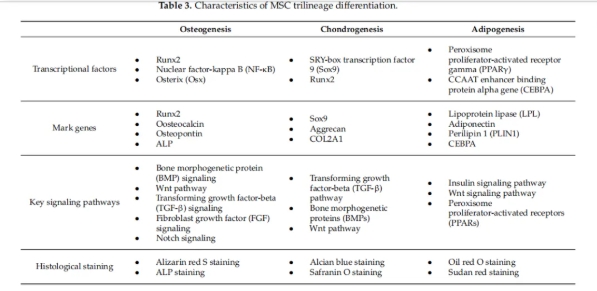
图4:MSC三系分化过程的关键特征
· 促进多系分化能力 ·
三维培养的MSCs在细胞存活和抗凋亡方面表现出显著优势。研究表明,三维培养的MSCs在多种条件下(如低氧、无血清或最小培养基)显示出更高的细胞活力和存活率。这种增强的细胞存活能力归因于细胞间和细胞与基质相互作用的增强,以及抗凋亡基因(如Bcl-2)的上调和凋亡基因(如Bax)的下调。
· 增强免疫调节功能 ·
三维培养的MSCs在免疫调节方面表现出显著的增强效果。研究表明,三维培养的MSCs能够通过分泌免疫调节因子(如PGE2和TSG6)和抑制炎症因子(如TNF-α)来增强其抗炎和免疫调节功能。此外,将MSCs组装成三维球体并结合poly(I:C)预处理,可提高MSCs在炎症性肠病(IBD)微环境中的存活率和免疫调节潜力。
· 促进血管生成和伤口愈合 ·
三维培养的MSCs在血管生成和伤口愈合方面也表现出显著的增强效果。研究表明,三维培养的MSCs能够分泌更多的血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)和碱性成纤维细胞生长因子(bFGF),从而增强其血管生成和伤口愈合能力。
· 神经保护作用 ·
三维培养的MSCs在神经保护方面也表现出显著的潜力。研究表明,通过使用含有丙戊酸诱导的复合支架,成功将MSCs分化为类似神经元的细胞。此外,三维培养的MSCs通过调节慢性炎症反应基因减轻神经病理性疼痛,并显著降低与炎症反应相关的基因表达水平。
· 多器官治疗潜力 ·
三维培养的MSCs在多个器官的治疗中显示出巨大的潜力。例如,在肺部,三维培养的MSCs能够增加肺泡分化;在肾脏,由MSCs和其他细胞组成的混合球体可改善肾功能;在肝脏,通过猪去细胞化肝脏支架培养脐带MSCs,成功构建了生物工程肝组织。
· 外泌体的治疗潜力 ·
三维培养的MSCs分泌的外泌体在治疗多种疾病方面表现出显著的潜力。研究表明,三维培养的MSCs分泌的外泌体能够调节免疫反应、促进组织再生和改善伤口愈合。例如,3D培养的MSCs可在体外长期维持MSCs活性,可长时间产生高治疗性的Exos。此外,3D-Exos具有更强的抗炎作用,可显著减少促炎因子分泌,更易被小胶质细胞内化。
· 疾病建模和药物筛选 ·
三维培养的MSCs在疾病建模和药物筛选方面具有重要的应用潜力。研究表明,三维培养的MSCs能够更好地模拟体内的病理生理过程,从而为疾病研究和药物筛选提供更准确的模型。
04
人工智能推动3D细胞培养未来
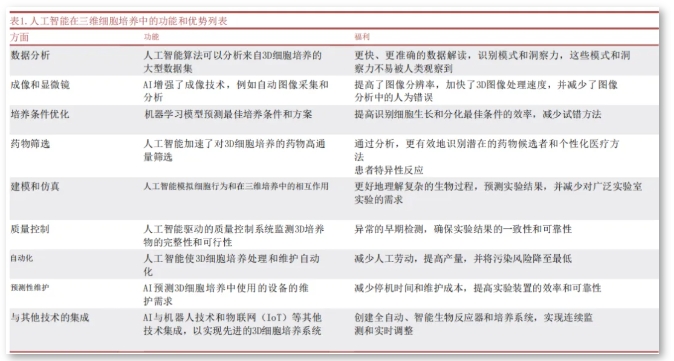
图5:人工智能在三维细胞培养中的功能和优势列表
· 智能化动态调控 ·
实时监测与反馈:3D智能化细胞培养系统集成了各种传感器,可实时监测细胞的生长状态、代谢情况等参数,并将数据传输至控制系统。控制系统根据预设的参数范围进行分析和判断,自动调整培养条件,实现智能化的反馈控制,确保细胞始终处于最佳生长状态。
数据分析与优化:智能化系统能够对大量的细胞培养数据进行分析,挖掘细胞生长的规律和关键影响因素,为优化培养工艺提供依据,有助于进一步提高细胞培养的质量和效率,推动细胞治疗、药物研发等领域的发展。
· 规模化生产突破 ·
高效利用空间:3D培养技术能够在有限的空间内构建出三维立体的细胞培养环境,相比传统的二维培养方式,可显著增加细胞培养的数量和密度,实现大规模细胞培养,提高生产效率。 便于自动化操作:3D智能化细胞培养系统通常配备自动化的仪器和设备,如自动加样器、细胞收获装置等,能够减少人工操作,提高培养效率,有利于大规模培养的标准化和质量控制。
· 标准化产品制备 ·
精确控制培养条件:3D智能化细胞培养系统可以精确控制温度、湿度、气体浓度、营养物质供应等培养条件,确保每个培养单元中的细胞都处于相同的环境中,从而提高细胞培养的一致性和重复性。 统一的培养流程:通过智能化的控制系统,3D细胞培养能够实现从细胞接种、培养到收获的全流程标准化操作,减少人为因素对实验结果的影响,减少多人多批次操作造成的批间差异,为大规模生产提供稳定可靠的细胞来源。
3D细胞培养技术在再生医学中的应用前景广阔,其在增强细胞存活、促进多系分化、提升免疫调节能力、推动血管生成和伤口愈合、疾病建模与药物筛选、神经保护以及多器官治疗等方面展现出显著的潜力。结合人工智能的自动化和数据分析能力,3D细胞培养技术不仅提高了实验效率、质量控制、数据准确性,还为个性化医疗和复杂疾病治疗提供了更强大的工具。随着技术的不断进步,3D细胞培养与人工智能的结合将为再生医学带来更多的突破,为患者带来新的希望。
结语
参考文献:
Gao Q, Cekuc MS, Ergul YS, Pius AK, Shinohara I, Murayama M, Susuki Y, Ma C, Morita M, Chow SK, Goodman SB. 3D Culture of MSCs for Clinical Application. Bioengineering (Basel). 2024 Nov 27;11(12):1199. doi: 10.3390/bioengineering11121199. PMID: 39768017; PMCID: PMC11726872.
Habanjar O, Diab-Assaf M, Caldefie-Chezet F, Delort L. 3D Cell Culture Systems: Tumor Application, Advantages, and Disadvantages. Int J Mol Sci. 2021 Nov 11;22(22):12200. doi: 10.3390/ijms222212200. PMID: 34830082; PMCID: PMC8618305.
https://www.cell.com/cellbiomaterials/fulltext/S3050-5623(25)00041-8